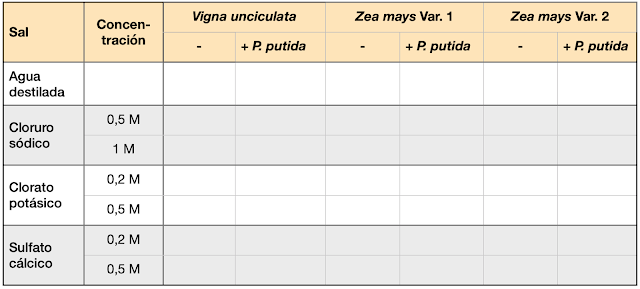
Como comentábamos en la anterior entrada dedicada a nuestro proyecto, uno de sus objetivos es valorar la tolerancia de determinadas plantas (maíz y carilla) ante suelos con elevada concentración salina. El exceso de sales en los suelos causa en las plantas estrés osmótico y altera el equilibrio homeostático de las mismas con el resultado de un menor crecimiento de las mismas. El segundo objetivo es comprobar si determinados microorganismos podrían favorecer el desarrollo de las plantas en estos ambientes de alta salinidad. Y para ello, el primer requisito es que estas bacterias sean capaces de sobrevivir en medios con una elevada concentración de sales.
 |
| Pseudomonas putida: imagen a microscopía confocal (izda.) y electrónica (dcha.). Cortesía de Juan de Dios Alché. |
Nuestro punto de partida para seleccionar los microorganismos han sido los experimentos de tolerancia a sales -concretamente a clorato potásico- que llevamos a cabo en nuestro proyecto sobre Marte. Tras valorar estos resultados todos habéis coincido en que las bacterias más adecuadas son: Bacillus subtilis, Pseudomonas putida y Halomonas sp. Nuestra primera actividad ha sido investigar en la literatura si alguna de las anteriores pudiera tener un efecto promotor del crecimiento de las plantas en presencia de concentraciones elevadas de sales. Vuestras propuestas, así como la justificación bibliográfica, se pueden consultar en la sección de comentarios de la entrada anterior. Incluyo aquí las más citadas o las que parecen más relevantes.
Pseudomonas putida:
Costa Gutiérrez, S.B. (2019). Microflora de la rizósfera de soja en condiciones de alta salinidad: aislamiento y estudio de cepas de Pseudomonas putida benéfica frente al estrés salino. Enlace. Hernández Montiel et al. (2020). Respuestas morfologías-productiva de plantas de pimiento morrón biofertilizadas con Pseudomonas putida y dosis reducidas de fertilizantes sintéticos en invernadero. Terra Latioamericana 38(3): 583-596. (Enlace).
Halomonas sp:
Desale et al. (2013). Plant Growth promoting properties of Halobacillus and Halomonas sp. in presence of salinity and heavy metals. Journal of Basic Microbiology, 54(8):781-791. (Enlace). Tiwari et al. (2011). Salt-tolerant rhizobacteria-mediated induced tolerance in wheat (Triticum aestivum) and chemical diversity in rhizosphere enhance plant growth. Biology and Fertility of Soils, 47, article number 907. (Enlace).
Bacillus subtilis:
Sánchez López et al. (2016). Efecto de las PGPB sobre el crecimiento de Pennisetum clandestinum bajo condiciones de estrés salino. Rev. Colomb. Biotecnol. 16(1):65-72. (Enlace). Calhabeu Ferreira et al. (2018). Bacillus subtitles improves maize tolerance to salinity. Ciencia Rural, v48:08. (Enlace)
Cultivar en suelos salinos es una necesidad en nuestro planeta. La acción antrópica, el calentamiento global por ejemplo, está aumentando la extensión de las zonas desérticas, en las que la alta concentración de sales en el suelo impide el crecimiento de las plantas. La investigación en este campo es, por ello, muy importante. Pero también puede ser un problema a resolver en el cada vez más que probable escenario de establecer colonias humanas en otros mundos, como la Luna o Marte.
En proyectos anteriores hemos evaluado la supervivencia de microorganismos en las condiciones de Marte o el crecimiento de plantas en suelos marcianos simulados de naturaleza puramente volcánica. Pero en Marte hay otros materiales que igualmente podrían presentar este problema debido a la presencia de sales en el suelo. La historia de Marte en el pasado fue similar a la de la Tierra, con grandes extensiones de agua líquida que se evaporó dejando importantes depósitos de sales en el suelo. El cráter Gale, estudiado por el rover Curiosity, es una estructura de impacto que en su momento contuvo un lago que posteriormente se secó.
 |
| Cráter Gale en Marte. Reconstrucción del lago que primigeniamente ocupaba la estructura de impacto. |
Nuestra tarea es ahora investigar sobre los suelos salinos de Marte. En lugares como el cráter Gale hay un importante depósito de arcillas y se ha descubierto la presencia de sales. Es ahora momento de investigar sobre los resultados obtenidos por los rovers en la superficie de Marte. ¿Cuáles son las sales más abundantes en Marte? ¿Dónde se han encontrado? ¿En qué concentración? ¿Cuál es la composición de los suelos en los que aparecen? ¿Hay suelos similares en la Tierra? ¿Se podrían cultivar plantas en esos suelos?
Nuestros comentarios deberán venir refrendados por las pertinentes referencias bibliográficas. Es importante citar los trabajos de la forma apropiada. Existen diversos formatos para hacer una referencia bibliográfica. En nuestro caso podemos adoptar el siguiente:
Autores, año de publicación, título del artículo, nombre de la revista, volumen, número de la primera y de la última página.
Debemos tomar e incluir también la dirección de internet donde se ha localizado el trabajo para facilitar futuras consultas.